La COVID-19 es una enfermedad infecciosa potencialmente mortal cuya rápida propagación a través del contacto entre personas y superficies infectadas la ha convertido en una pandemia según la Organización Mundial de la Salud. Hasta la fecha, se han registrado más de 483 millones de casos confirmados y 6.3 millones de muertes1, lo que ha afectado significativamente a las actividades económicas y al estilo de vida en todo el mundo2.
El virus responsable de esta enfermedad, el SARS-CoV-2, es un betacoronavirus estrechamente relacionado con el SARS-CoV3, ambos con el mismo mecanismo de entrada viral4 que depende de la proteína “Spike” (S) y de su dominio de unión al receptor (RBD), el cual es esencial para mediar la unión de la proteína S al receptor humano ACE25,6. Por lo tanto, S y el RBD son las principales dianas terapéuticas, para las que existen varias vacunas y fármacos candidatos que actualmente se están evaluando clínicamente como contramedidas contra la COVID-19.
Las vacunas basadas en virus inactivados, ARNm y las que utilizan vectores virales7,8,9 se han aplicado para controlar el brote; sin embargo, existen importantes problemas que hay que superar, como el largo proceso de desarrollo10, las variantes del SARS-CoV-2 que escapan a los anticuerpos inducidos por la vacuna y que aparecen con el tiempo11,12, la reticencia a la vacunación que alcanza más del 40% en varios países y que afecta a adultos y niños a través de la actitud de los padres13,14, y las personas inmunodeprimidas en las que las tasas de seroconversión son significativamente menores15. Además, el acceso a las vacunas está restringido para los países en desarrollo debido al control que ejercen los titulares de las patentes y las empresas farmacéuticas sobre los precios16.
En este sentido, el tratamiento mediante inmunización pasiva podría ser una opción adecuada como ayuda a la vacunación, ya que ha tenido un papel importante en el control de múltiples enfermedades, incluida la pandemia causada por el virus de la gripe H1N117,18,19. Este enfoque ya se ha aplicado en pacientes con COVID-19 grave en los que se utilizó plasma de pacientes convalecientes, lo que condujo a la reducción de la viremia y a una mejora clínica sustancial20,21.
De este modo, los anticuerpos IgG anti-SARS-CoV-2 tienen un importante potencial terapéutico, sin embargo existen algunas dificultades como la baja cantidad de anticuerpos específicos recuperados de un paciente, y las posibles reacciones adversas que podrían presentarse como un aumento de la enfermedad pro-inflamatoria mediada por los anticuerpos conocido como aumento dependiente de anticuerpos (ADE), o la exacerbación de la endocitosis o fagocitosis viral en las células del huésped a través de los receptores Fc debido a la presencia de anticuerpos no neutralizantes, lo que potencia la replicación viral22.
Por otro lado, el potencial terapéutico de las IgY (inmunoglobulinas de yema) ha sido ampliamente revisado a lo largo de los años, siendo utilizadas tanto en el tratamiento como en la prevención de múltiples enfermedades respiratorias23,24, y demostrando ser un prometedor método terapéutico de inmunidad pasiva ya que las IgY no activan el complemento humano ni inducen respuesta alérgica en la mayoría de la población, garantizando la seguridad cuando se administran en mamíferos, reportando además una gran estabilidad en un amplio rango de condiciones de temperatura y pH25,26.
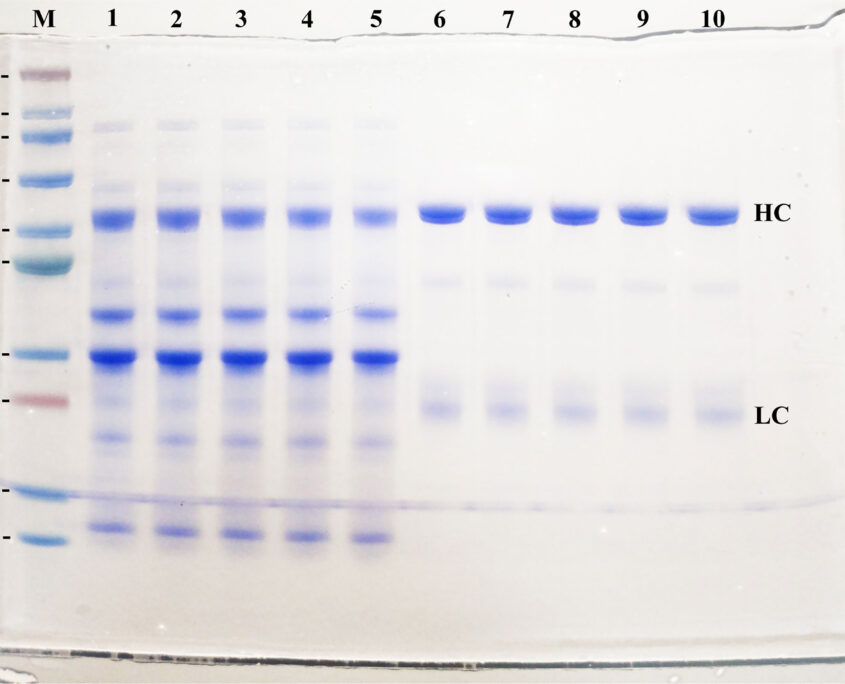
En este estudio, se produjeron anticuerpos IgY anti-RBD inmunizando a gallinas SPF con una proteína RBD recombinante, y se probó la inmunoreactividad in vitro. Posteriormente, se realizó un ensayo de desafío con SARS-CoV-2 para evaluar la eficacia de los IgY como tratamiento profiláctico y posterior a la infección.
Referencias
-
- WHO COVID-19 Dashboard. Geneva: World Health Organization, 2020. Who.int. https://covid19.who.int/table
- Molarius A, Persson C. Living conditions, lifestyle habits and health among adults before and after the COVID-19 outbreak. Eur J Public Health. 2021;31(Supplement_3). http://dx.doi.org/10.1093/eurpub/ckab165.030
- Zheng J. SARS-CoV-2: an Emerging Coronavirus that Causes a Global Threat. Int J Biol Sci. 2020;16(10):1678–85. http://dx.doi.org/10.7150/ijbs.45053
- Li W, Moore MJ, Vasilieva N, Sui J, Wong SK, Berne MA, et al. Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus. Nature. 2003;426(6965):450–4. http://dx.doi.org/10.1038/nature02145
- Lan J, Ge J, Yu J, Shan S, Zhou H, Fan S, et al. Structure of the SARS-CoV-2 spike receptor-binding domain bound to the ACE2 receptor. Nature. 2020;581(7807):215–20. http://dx.doi.org/10.1038/s41586-020-2180-5
- Yan R, Zhang Y, Li Y, Xia L, Guo Y, Zhou Q. Structural basis for the recognition of SARS-CoV-2 by full-length human ACE2. Science. 2020;367(6485):1444–8. http://dx.doi.org/10.1126/science.abb2762
- Buschmann MD, Carrasco MJ, Alishetty S, Paige M, Alameh MG, Weissman D. Nanomaterial delivery systems for mRNA vaccines. Vaccines (Basel). 2021;9(1):65. http://dx.doi.org/10.3390/vaccines9010065
- Dong Y, Dai T, Wei Y, Zhang L, Zheng M, Zhou F. A systematic review of SARS-CoV-2 vaccine candidates. Signal Transduct Target Ther. 2020;5(1):237. http://dx.doi.org/10.1038/s41392-020-00352-y
- Amanat F, Krammer F. SARS-CoV-2 vaccines: Status report. Immunity. 2020;52(4):583–9. http://dx.doi.org/10.1016/j.immuni.2020.03.007
- Shahcheraghi SH, Ayatollahi J, Aljabali AA, Shastri MD, Shukla SD, Chellappan DK, et al. An overview of vaccine development for COVID-19. Ther Deliv. 2021;12(3):235–44. http://dx.doi.org/10.4155/tde-2020-0129
- Planas D, Veyer D, Baidaliuk A, Staropoli I, Guivel-Benhassine F, Rajah MM, et al. Reduced sensitivity of SARS-CoV-2 variant Delta to antibody neutralization. Nature. 2021;596(7871):276–80. http://dx.doi.org/10.1038/s41586-021-03777-9
- Zhou D, Dejnirattisai W, Supasa P, Liu C, Mentzer AJ, Ginn HM, et al. Evidence of escape of SARS-CoV-2 variant B.1.351 from natural and vaccine-induced sera. Cell. 2021;184(9):2348-2361.e6. http://dx.doi.org/10.1016/j.cell.2021.02.037
- Sallam M. COVID-19 vaccine hesitancy worldwide: A concise systematic review of vaccine acceptance rates. Vaccines (Basel). 2021;9(2):160. https://www.mdpi.com/2076-393X/9/2/160
- Marshall S, Moore AC, Sahm LJ, Fleming A. Parent Attitudes about Childhood Vaccines: Point Prevalence Survey of Vaccine Hesitancy in an Irish Population. Pharmacy 2021;9(4):188. http://dx.doi.org/10.3390/pharmacy9040188
- Lee ARYB, Wong SY, Chai LYA, Lee SC, Lee MX, Muthiah MD, et al. Efficacy of covid-19 vaccines in immunocompromised patients: systematic review and meta-analysis. BMJ [Internet]. 2022 [cited 2022 Mar 31];376:e068632. Available from: https://www.bmj.com/content/376/bmj-2021-068632
- Ekström AM, Berggren C, Tomson G, Gostin LO, Friberg P, Ottersen OP. The battle for COVID-19 vaccines highlights the need for a new global governance mechanism. Nat Med. 2021;27(5):739–40. http://dx.doi.org/10.1038/s41591-021-01288-8
- Rudraraju R, Subbarao K. Passive immunization with influenza haemagglutinin specific monoclonal antibodies. Hum Vaccin Immunother. 2018;1–9. http://dx.doi.org/10.1080/21645515.2018.1489947
- Pearl KK, Ortiz AA, Pearl W. Efficacy of immunization with a combination of serum and recombinant hepatitis B vaccines. Infect Control Hosp Epidemiol. 1993;14(8):476–8. http://dx.doi.org/10.1086/646783
- Pavia CS, Wormser GP. Passive immunization and its rebirth in the era of the COVID-19 pandemic. Int J Antimicrob Agents. 2021;57(3):106275. http://dx.doi.org/10.1016/j.ijantimicag.2020.106275
- Focosi D, Tuccori M, Franchini M. The road towards polyclonal anti-SARS-CoV-2 immunoglobulins (hyperimmune serum) for passive immunization in COVID-19. Life (Basel). 2021;11(2):144. http://dx.doi.org/10.3390/life11020144
- Abraham J. Passive antibody therapy in COVID-19. Nat Rev Immunol. 2020;20(7):401–3. http://dx.doi.org/10.1038/s41577-020-0365-7
- Montelongo-Jauregui D, Vila T, Sultan AS, Jabra-Rizk MA. Convalescent serum therapy for COVID-19: A 19th century remedy for a 21st century disease. PLoS Pathog. 2020;16(8):e1008735. http://dx.doi.org/10.1371/journal.ppat.1008735
- Nguyen HH, Tumpey TM, Park H-J, Byun Y-H, Tran LD, Nguyen VD, et al. Prophylactic and therapeutic efficacy of avian antibodies against influenza virus H5N1 and H1N1 in mice. PLoS One. 2010;5(4):e10152. http://dx.doi.org/10.1371/journal.pone.0010152
- Yang Y-E, Wen J, Zhao S, Zhang K, Zhou Y. Prophylaxis and therapy of pandemic H1N1 virus infection using egg yolk antibody. J Virol Methods. 2014;206:19–26. http://dx.doi.org/10.1016/j.jviromet.2014.05.016
- Pereira EPV, van Tilburg MF, Florean EOPT, Guedes MIF. Egg yolk antibodies (IgY) and their applications in human and veterinary health: A review. Int Immunopharmacol. 2019;73:293–303. http://dx.doi.org/10.1016/j.intimp.2019.05.015
- Constantin C, Neagu M, Diana Supeanu T, Chiurciu V, A Spandidos D. IgY – turning the page toward passive immunization in COVID-19 infection (Review). Exp Ther Med. 2020;20(1):151–8. http://dx.doi.org/10.3892/etm.2020.8704
Estudio Completo Publicado:
https://www.frontiersin.org/articles/10.3389/fimmu.2022.881604/full?&utm_source=Email_to_authors_&utm_medium=Email&utm_content=T1_11.5e1_author&utm_campaign=Email_publication
- &field=&journalName=Frontiers_in_Immunology&id=881604

 TIFOVAC SE DUO
TIFOVAC SE DUO